已知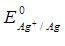 =0.7995V和AgI的Ksp=9.3×10-17若在I-保持1.0mol/L溶液中则上述电对的电极电位应是()。
=0.7995V和AgI的Ksp=9.3×10-17若在I-保持1.0mol/L溶液中则上述电对的电极电位应是()。
A . -0.146V
B . 0.146V
C . 0.327V
D . -0.327V
参考答案与解析:
-
相关试题
-
已知=0.793V和Hg2Cl2的Ksp=1.3×10-18若在Cl
-
[单选题]已知=0.793V和Hg2Cl2的Ksp=1.3×10-18若在Cl-保持0.010mol/L溶液中则上述电对的电极电位应是()。A . 0.026VB . -0.026VC . 0.383VD . -0.383V
- 查看答案
-
已知KSPAgCl=1.8×10-10,KSPAgI=8.7×10-17,两者比
-
[填空题] 已知KSP•AgCl=1.8×10-10,KSP•AgI=8.7×10-17,两者比较,更难溶解的是()。
- 查看答案
-
已知φθ(Fe3+/Fe2+)=0.77V,φθ(I2/I-)=0.54V,则标
-
[单选题]已知φθ(Fe3+/Fe2+)=0.77V,φθ(I2/I-)=0.54V,则标态下能发生的反应为()A .2Fe3++I2=2Fe2++2I-B .2Fe3++2I-=2Fe2++I2C .2Fe2++2I-=2Fe3++I2D .2Fe2++I2=2Fe3++2I-
- 查看答案
-
已知电对I2/I-和MnO4-/Mn2+在25℃时的分别为0.54V和1.51V
-
[单选题]已知电对I2/I-和MnO4-/Mn2+在25℃时的分别为0.54V和1.51V,若将其构成原电池,总反应为:2MnO4-+16H++10I-=2Mn2++8H2O+5I2,则该原电池的电动势为()。A . 0.97VB . 0.65VC . 0.03VD . -0.97V
- 查看答案
-
已知Kspθ(AB2)=3.2×10-11,Kspθ(AB)=4.0×10-8,
-
[单选题]已知Kspθ(AB2)=3.2×10-11,Kspθ(AB)=4.0×10-8,则两者在水中溶解度关系为()。A . S(AB)<S(A2B)B . S(AB)>S(A2B)C . S(AB)=S(A2B)D . 不能确定
- 查看答案
-
硝酸银滴定法测定水中氯化物时,已知氯化银Ksp=1.8×10-10,
-
[问答题] 硝酸银滴定法测定水中氯化物时,已知氯化银Ksp=1.8×10-10,碘化银Krp=1.5×10-16,假如在CL-和L-含量相等的溶液中逐滴加入硝酸银溶液,试问:(1)哪种离子首先被沉淀出来?(2)当第二种离子被沉淀时,CI-和I-的浓度比是多少?(3)第二种离子开始沉淀时,还有没有第一种沉淀物继续生成?
- 查看答案
-
根据下列反应构成原电池,测得它的标准电动势=0.444V,已知电对I2/I-的为
-
[单选题]根据下列反应构成原电池,测得它的标准电动势=0.444V,已知电对I2/I-的为0.534V作阳极,则电对的为()。A . -0.090VB . 0.978VC . 0.090VD . -0.978V
- 查看答案
-
已知KSP(AgCl)=1.2×10-10,在0.006mol/LNaCl溶液中
-
[单选题]已知KSP(AgCl)=1.2×10-10,在0.006mol/LNaCl溶液中逐滴加入AgNO3,开始出现沉淀时,溶液中C(Ag+)为()A .1.2×10-10mol/LB .2×10-8mol/LC .7.2×10-13mol/L
- 查看答案
-
设i为整型量,执行循环语句for(i=50;i>=0;i-=10);后,i值为(
-
[单选题]设i为整型量,执行循环语句for(i=50;i>=0;i-=10);后,i值为()A . -10B . 0C . 10D . 50
- 查看答案
-
设v+、v-分别是理想运放的同相输入端、反相输入端的电位;设i+、i-分别是该两
-
[单选题]设v+、v-分别是理想运放的同相输入端、反相输入端的电位;设i+、i-分别是该两端的输入电流。若运放工作于线性区,则()。A .v+>v->0,i+=i-=0B .v+=v-=0,i+=i->0C .v+=v-,i+=i-=0D .v+=v->0,i+=i->0
- 查看答案
